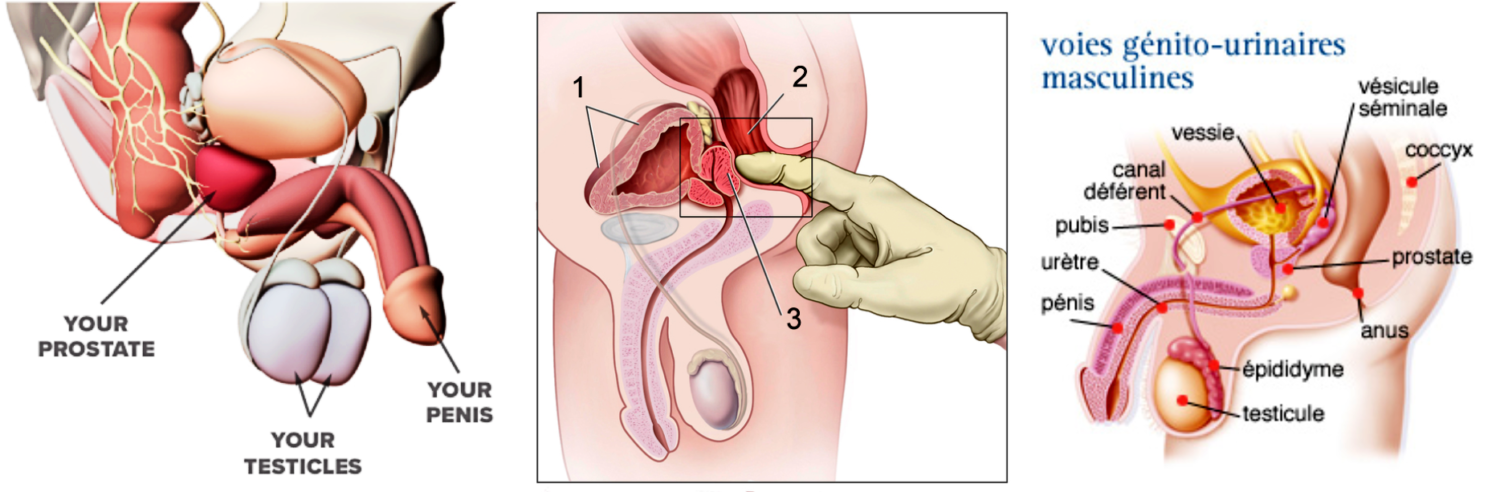
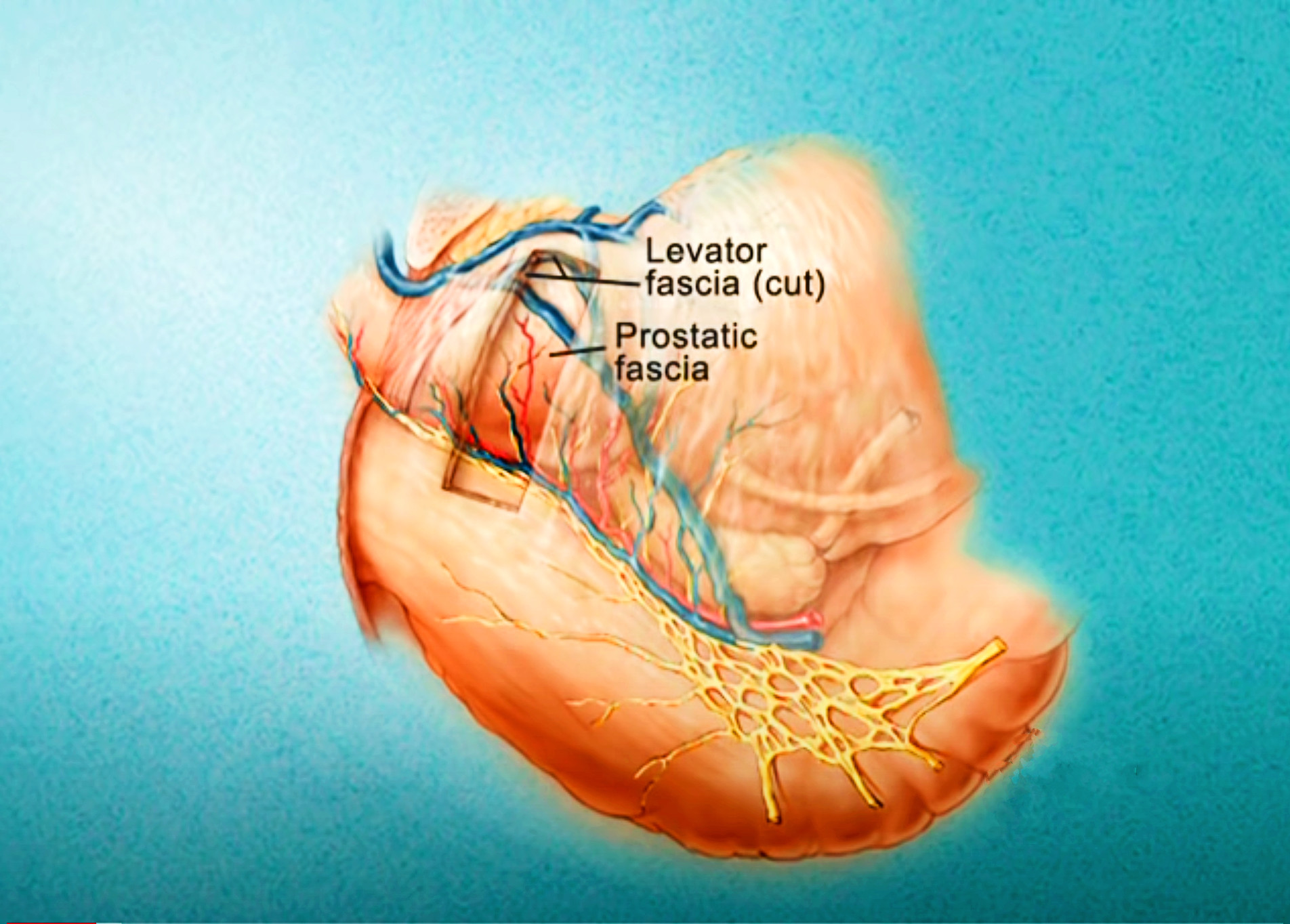
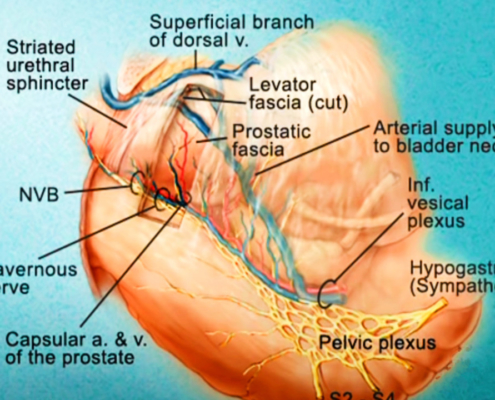
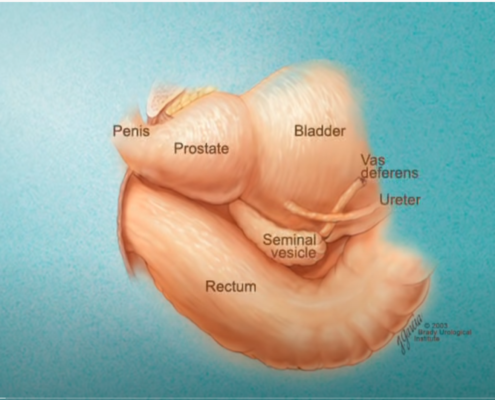
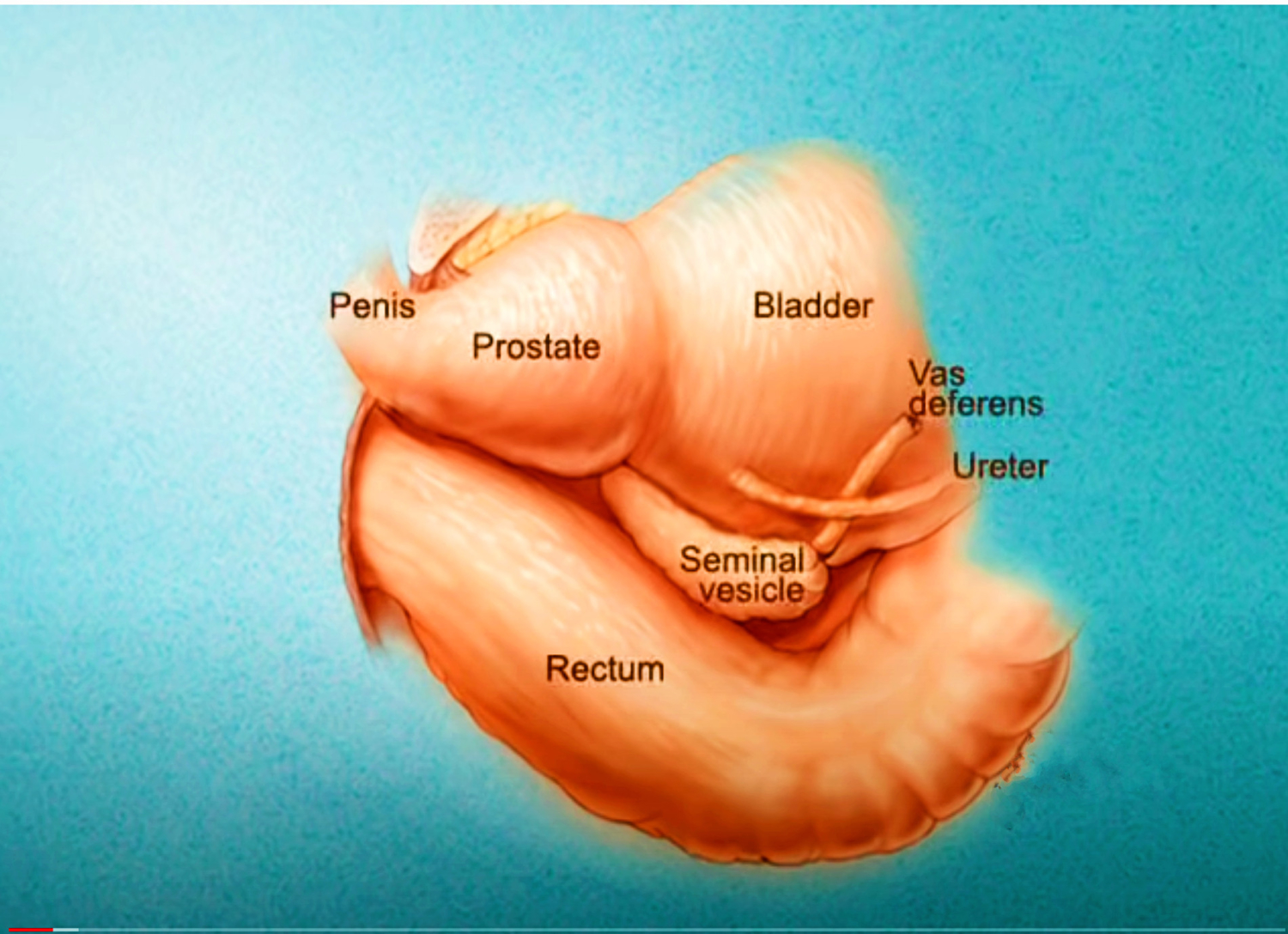
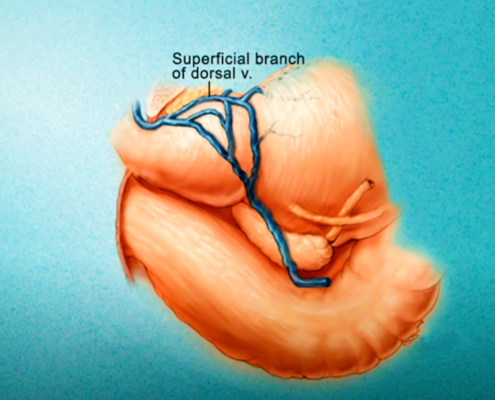
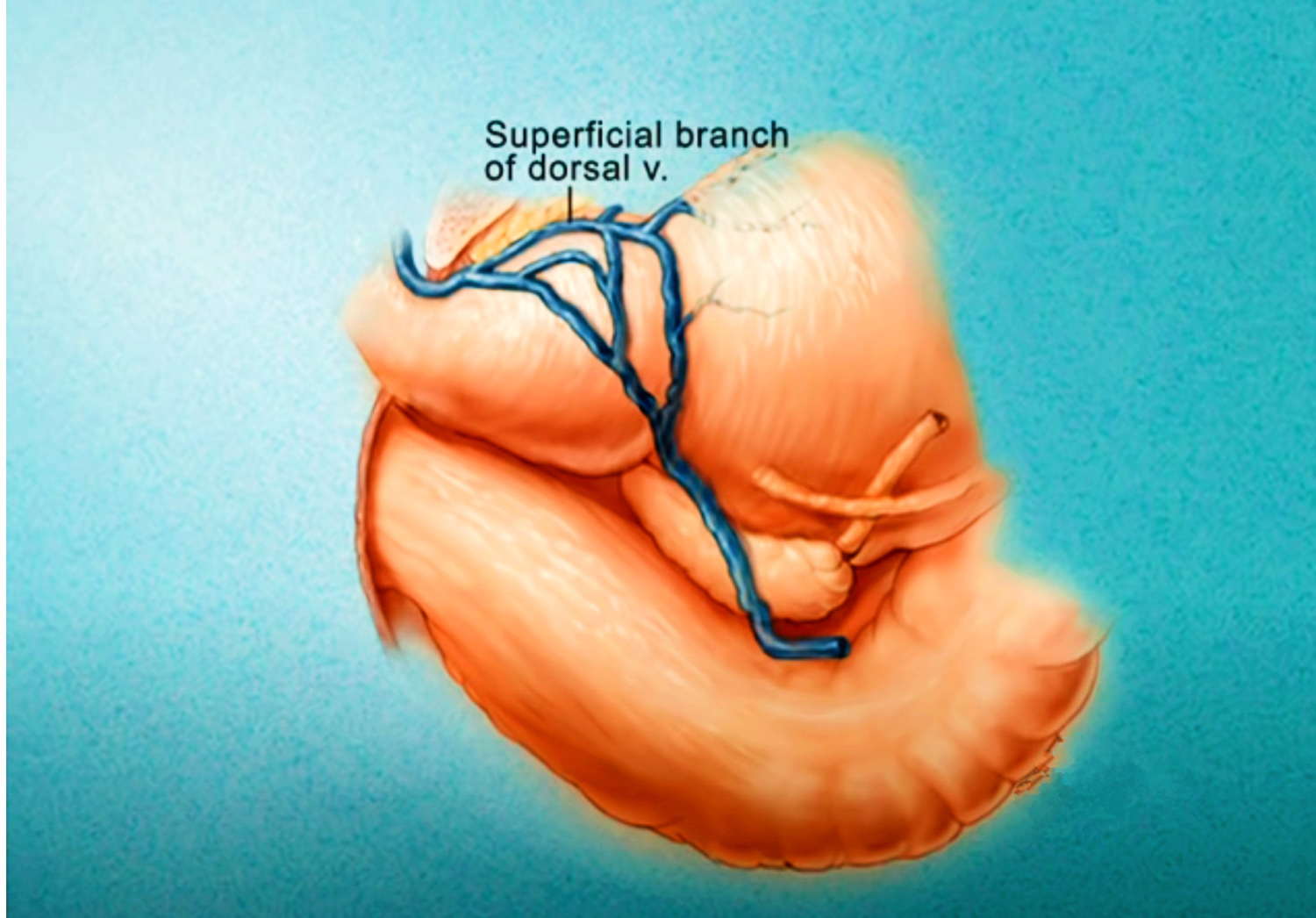
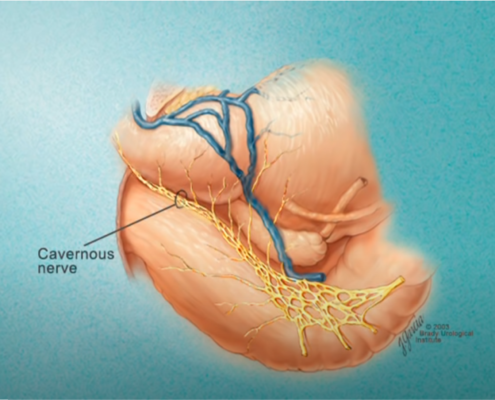
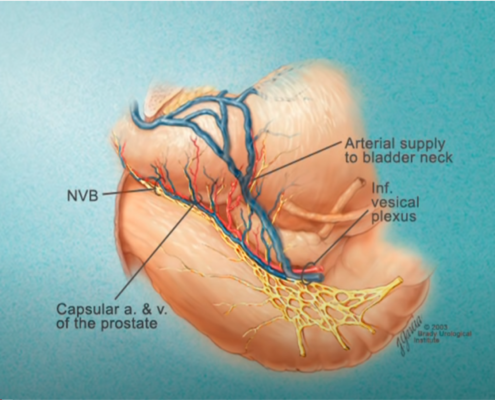
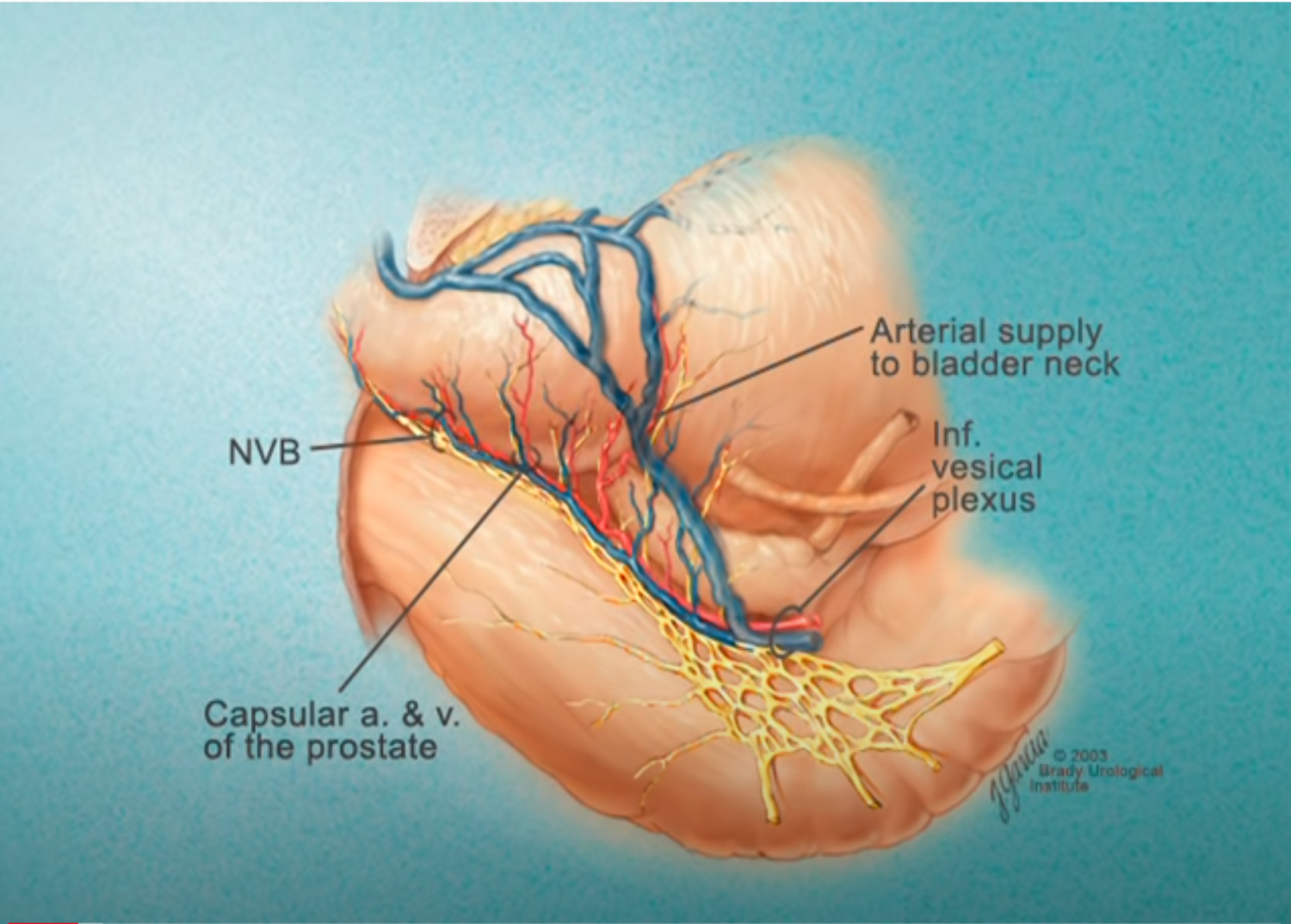
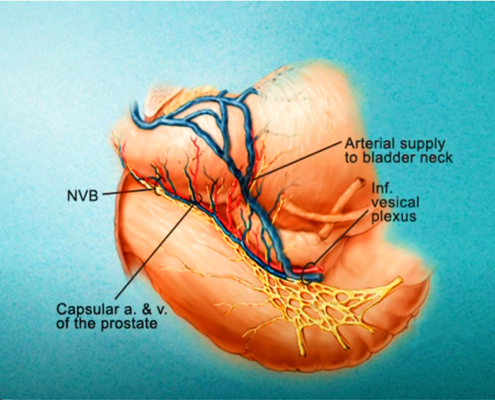
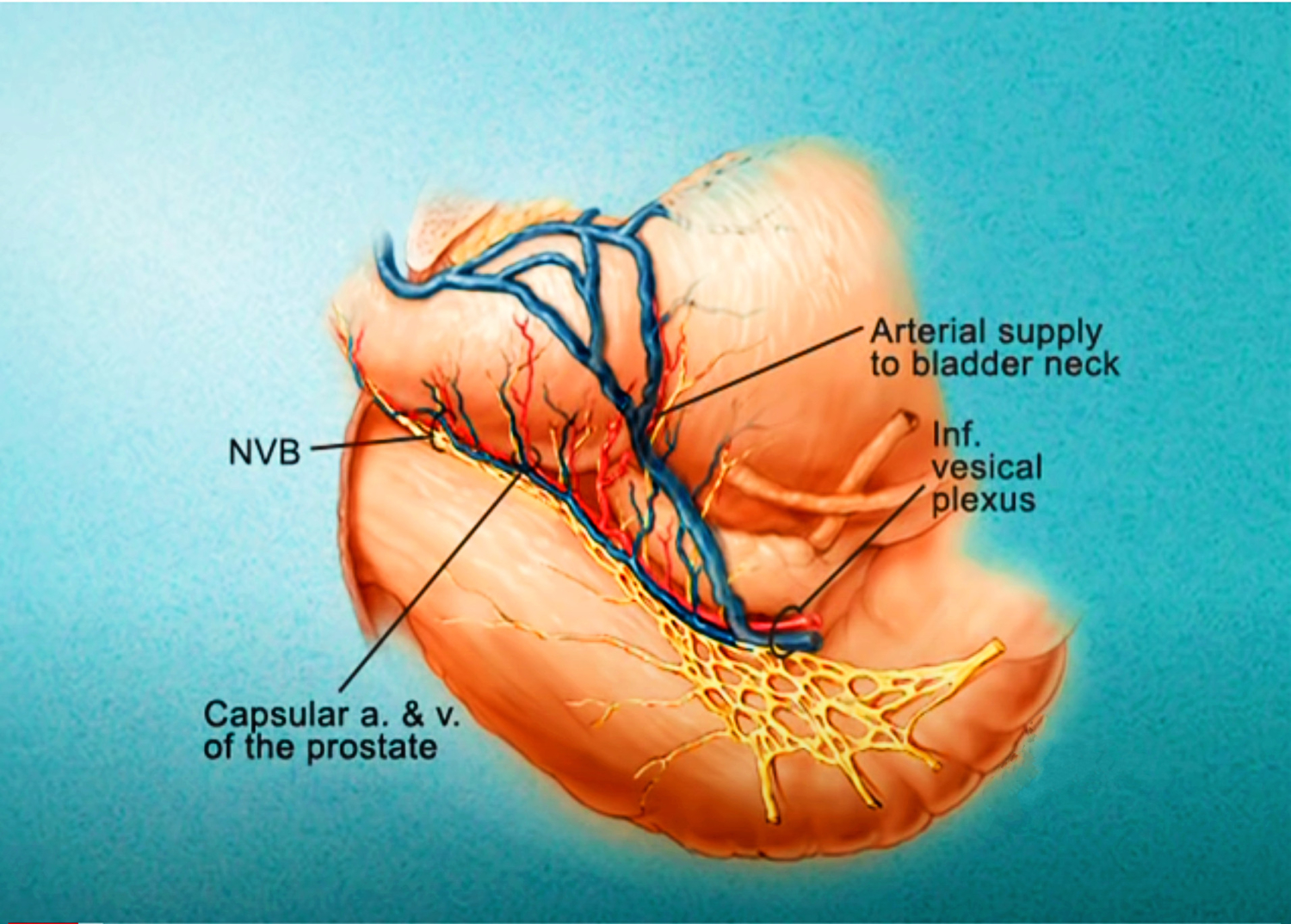
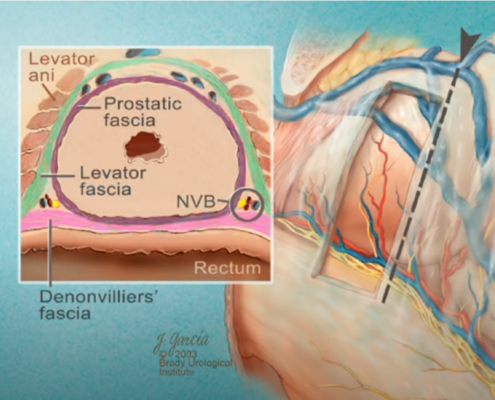
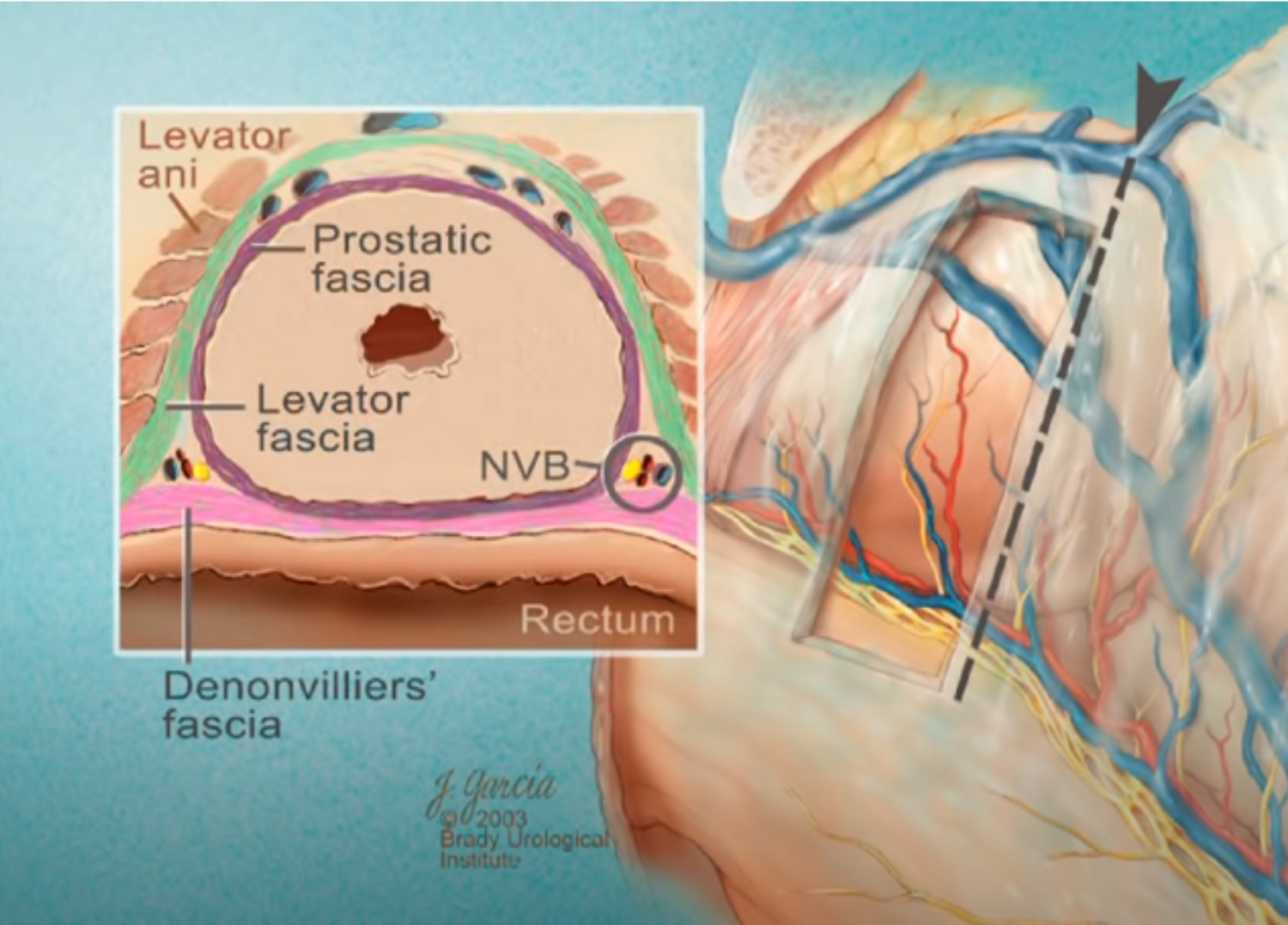
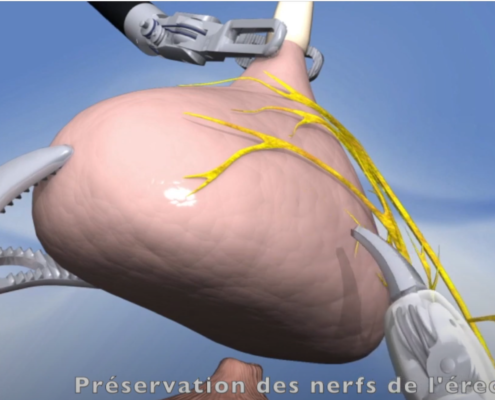
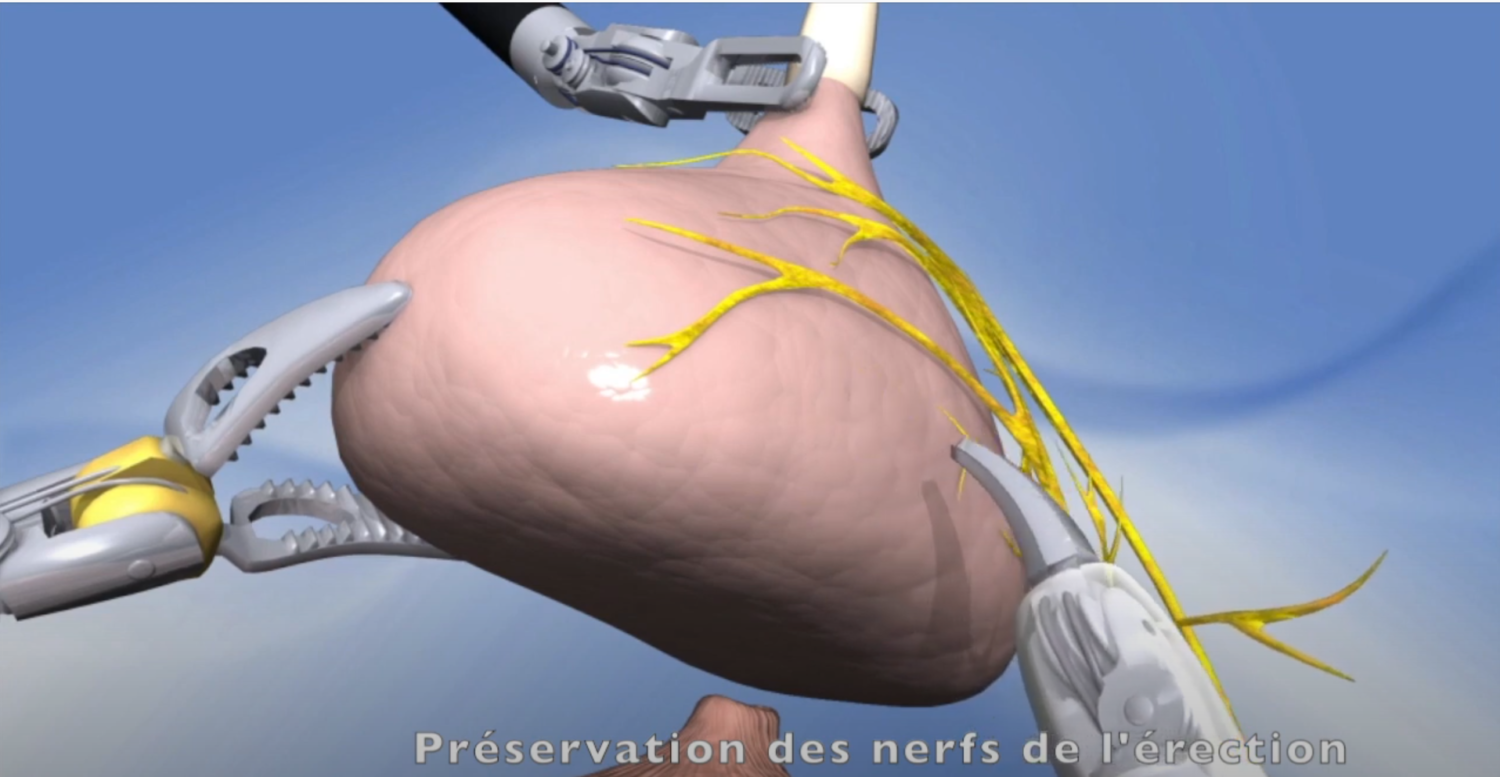
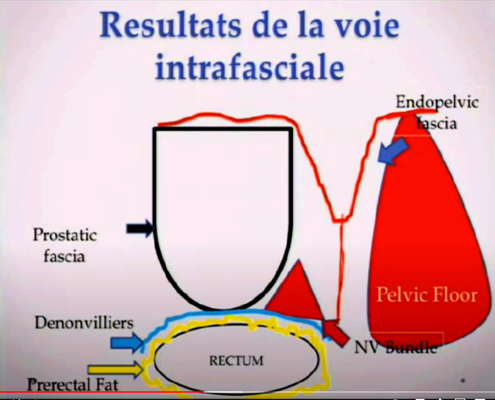
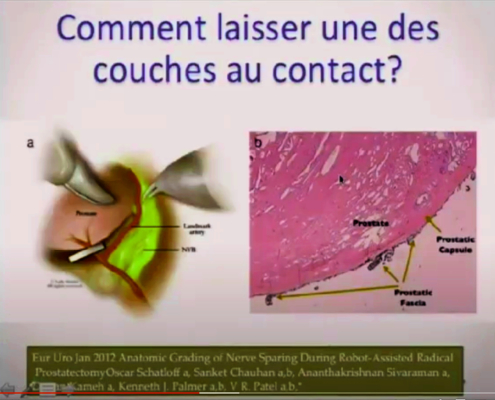
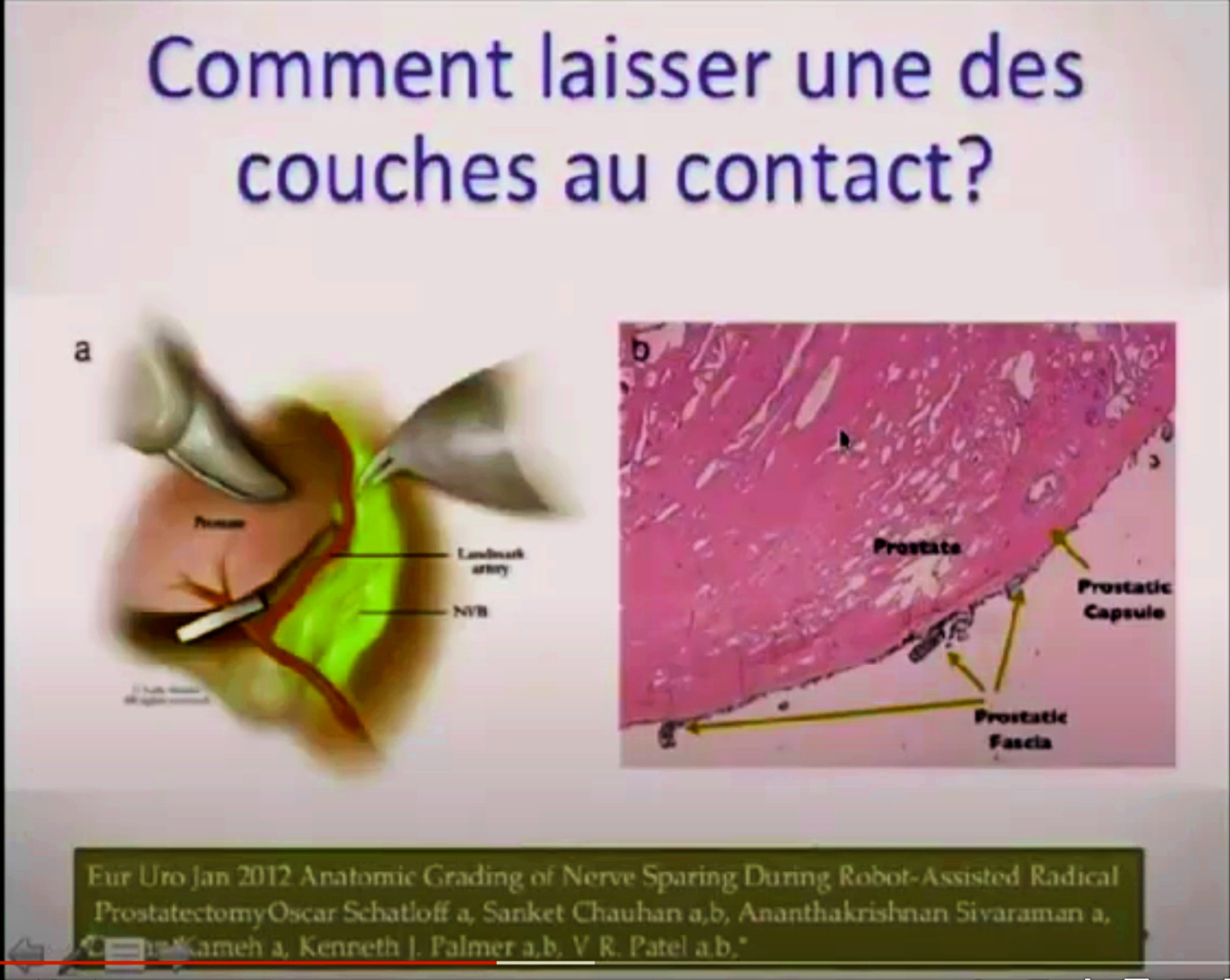
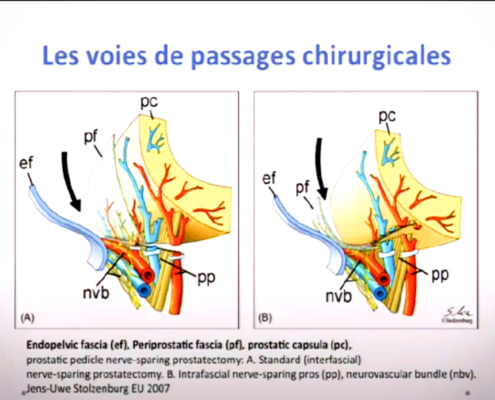
Imagerie comme l’IRMmp ou ceux d’une biopsie,
Qu’est-ce qu’un PI-RADS?
PI-RADS est un acronyme pour Prostate Imaging Reporting and Data System à partir des images obtenues à la suite d’un test d’imagerie telle l’imagerie par résonance magnétique multiparamétrique (IRMmp). C’est une échelle d’évaluation de la probabilité qu’un cancer de la prostate cliniquement significatif soit présent. C’est un système à 5 chiffres, du moins probable au plus probable.
En d’autres mots, lorsqu’une IRMmp est effectuée, les résultats sont interprétés en PI-RADS.
Révision médicale par le chirurgien-urologue Dr Thierry Lebeau le 23/03/2022
Le système PI-RADS a été développé par un panel de spécialistes de l’imagerie de la prostate. Son objectif était simple: améliorer l’accord entre les radiologues qui interprètent les résultats d’IRM de la prostate en fournissant des descriptions détaillées et standardisées des séquences d’imagerie à utiliser et de la façon dont le cancer de la prostate apparaît dans chaque séquence.
L’IRMmp
L’IRM est devenue de plus en plus utile pour reconnaître les zones anormales dans les prostates qu’on soupçonne cancéreuses. Bien qu’elle ne remplace pas une biopsie de la prostate, les médecins utilisent de plus en plus la technologie d’imagerie pour faciliter le diagnostic et le traitement du cancer de la prostate. L’IRMmp est l’une de ces technologies.
Si l’IRM standard permet de détecter une tumeur dans la prostate, l’IRMmp fournit davantage de détails sur son emplacement exact, son agressivité et sa propagation hors de la prostate. Cela pourrait aider votre médecin à décider si vous avez besoin d’une biopsie.
L’IRMmp est un examen qui consiste à créer des images en trois dimensions détaillées de votre prostate et des tissus environnants, grâce à des ondes et un champ magnétique. Les images sont reconstituées par un ordinateur et interprétées par un radiologue.
Les scores PI-RADS de 1 à 5
Le radiologue attribuera aux images obtenues de votre prostate un score Pi-RADS de 1 à 5. Plus le chiffre est élevé, plus il est probable que vous soyez atteint du cancer de la prostate et que vous ayez besoin d’une biopsie.
Si votre score PI-RADS est de 1 ou 2, cela signifie qu’il est peu probable que vous ayez un cancer de la prostate qui doit être traité. Votre médecin peut alors décider que vous n’avez pas besoin de subir une biopsie. Il pourrait plutôt vous suggérer de mesurer votre taux d’APS régulièrement afin d’intervenir si vos résultats indiquent une hausse anormale de l’APS.
Si votre score PI-RADS est de 3, votre médecin examinera les autres résultats de vos tests pour décider si vous devez subir une biopsie de la prostate.
Si votre score PI-RADS est de 4 ou 5, on vous proposera généralement une biopsie de la prostate pour savoir si vous avez un cancer.

Un consensus a été atteint sur l’orientation de l’imagerie axiale vers le patient et non vers la position de la prostate. Bien que cette dernière soit l’orientation de choix pour la correspondance des IRM aux échantillons de prostatectomie particulièrement utilisés dans la recherche, dans le cadre d’hommes subissant une surveillance avec des examens répétés pour surveiller tout changement d’intervalle dans la taille de la lésion, l’imagerie axiale du patient a été considérée comme utile pour améliorer la cohérence et la reproductibilité des scans et des mesures des lésions, même si cela nécessite une validation. De plus, l’intervention directe des radiologues pendant l’examen est réduite.
Imagerie pondérée en T2 (T2W)Le panel a approuvé la déclaration précédente 12 selon laquelle cette séquence devrait être acquise dans les trois plans (le plan sagittal étant utile pour la planification pré‐chirurgicale et une meilleure visualisation du col de la vessie). En particulier, le T2W devrait être obtenu en trois acquisitions distinctes (axiale, coronale et sagittale, bidimensionnelle [2D], écho de spin rapide [FSE], multicoupe) au lieu d’une acquisition 3D unique jusqu’à ce que des recherches plus approfondies sur la comparaison directe des diagnostics la qualité et la visibilité du cancer de 2D vs 3D T2W pour la zone périphérique (PZ) et la zone de transition (TZ) sont disponibles 14 , 15 . La résolution maximale dans le plan de la taille des voxels des séquences T2 doit être ≤ 0,7 mm, conformément aux recommandations précédentes 11 , 12. L’utilisation de séquences T2 avec un large champ de vision pour couvrir les ganglions abdominaux en dehors du bassin a été remise en question et n’a pas été considérée comme une exigence essentielle, car l’IRM a une faible performance pour la détection de la maladie ganglionnaire par rapport aux techniques d’imagerie fonctionnelle telles que la choline. ou la tomographie par émission de positrons (TEP) avec un antigène membranaire spécifique de la prostate, en particulier lorsqu’il existe un risque clinique de propagation métastatique ganglionnaire 16 , 17 .
Séquences d’imagerie pondérée en diffusion (DWI)La valeur minimale de high ‐ b pour les séquences de diffusion doit être b = 1 400 s/mm 2 à 1,5 T et b = 2 000 s/mm 2 à 3 T 11 , 12 . Bien qu’aucun consensus n’ait été atteint, la majorité a soutenu la préférence pour une séquence b élevée acquise séparément par rapport à des images à valeur b élevée extrapolées/calculées . Des preuves supplémentaires sur la comparaison entre les acquisitions d’images à haute valeur b « extrapolées » et « séparées » pour la détection du cancer de la prostate validée par histologie seraient utiles 18. La résolution maximale dans le plan de la taille de voxel de DWI doit autant que possible être maintenue à ≤ 2 mm, conformément aux directives britanniques précédentes 11 .
Imagerie dynamique à contraste amélioré (DCE)Le comité a reconnu que l’IRM‐DCE est un composant essentiel de l’IRMp de la prostate pour la détection, la stadification et la planification du traitement 19 , 20 . Le DCE‐MRI agit comme un « filet de sécurité » ou une séquence mpMRI « de secours », en particulier lorsque les images DWI sont dégradées, ce qui n’est pas rare en pratique courante (par exemple en raison de gaz rectaux). L’analyse DCE‐IRM doit être effectuée visuellement, avec une évaluation anatomique dans les premières images de rehaussement artériel de la prostate. La modélisation pharmacocinétique quantitative du DCE ou l’évaluation paramétrique de la forme de la courbe ont été jugées inutiles. Cela signifie que la résolution temporelle peut aller jusqu’à 15 s entre les scans pour permettre une résolution spatiale élevée et une interprétation anatomique des images DCE‐MRI.
Section III : Normes pour les rapports cliniques d’IRMp de la prostate
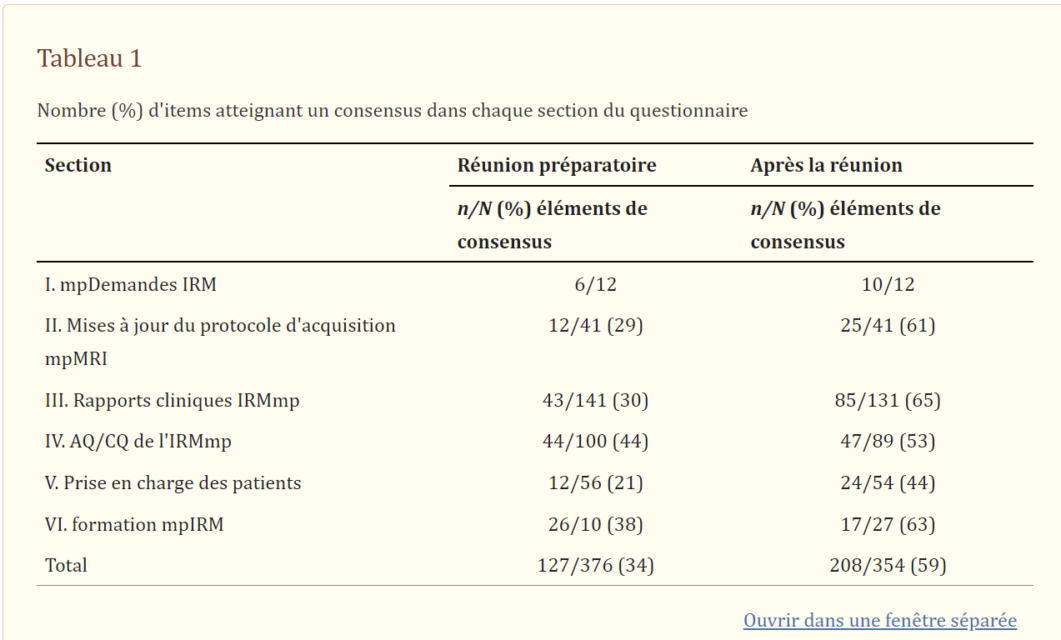
TableTableau 33résume les résultats de cette section.

Qui peut signaler l’IRMp de la prostate ?Compte tenu de l’expertise requise pour rendre compte de l’IRMmp, le comité a recommandé que seuls les uro‐radiologues ou les radiologues ayant un intérêt spécialisé dans l’imagerie du cancer de la prostate produisent des rapports d’IRMmp de la prostate. Ils doivent rapporter au moins 100 examens mpMRI par an avec l’exigence d’une participation active aux réunions de l’équipe multidisciplinaire (MDT) d’au moins deux fois par mois. Les autres spécialistes (radiologues généralistes, radiographes IRM, urologues ou uro‐oncologues) ne devraient être en mesure d’examiner/de démontrer les résultats de l’IRMp de la prostate que dans le cadre de leur pratique (par exemple, un urologue examinerait une IRM avant d’effectuer une biopsie ciblée, mais les images aurait déjà été formellement signalée par un radiologue expert en IRM de la prostate).
Seuils significatifs de définition du cancer pour l’évaluation par IRMmpReconnaissant les différences d’opinions sur les définitions du cancer de la prostate significatif, il y a eu un consensus pour s’aligner sur les définitions du cancer cliniquement significatif telles que décrites dans PI‐RADS_v2 12 . Plus précisément, l’IRMmp doit être notée pour exclure un score de Gleason ≥ 3 + 4 et/ou un volume ≥ 0,5 mL et/ou une extension extraprostatique/invasion des vésicules séminales.
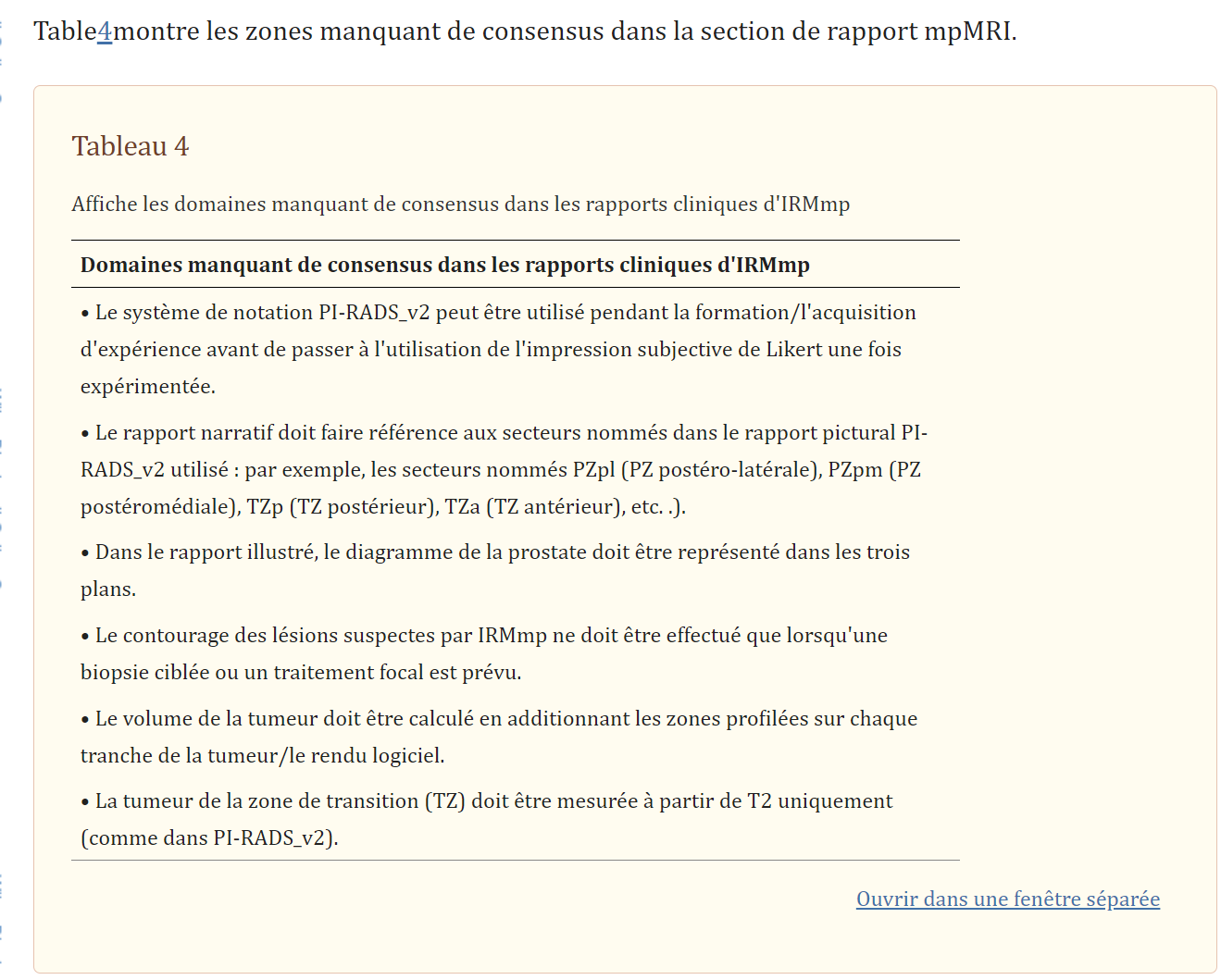
Rapports cliniques d’IRMp de la prostateIl y avait un consensus sur l’utilisation d’une échelle d’impression de Likert en 5 points (basée sur l’opinion et l’expérience globales du radiologue sans l’utilisation d’une séquence IRM dominante) pour évaluer la probabilité d’une maladie cliniquement significative dans les rapports de routine, comme validé de manière prospective dans l’étude multi ‐centre de l’étude PROMIS 8 . Il n’y avait pas de consensus sur l’utilisation systématique du système de notation PI‐RADS_v2 actuel d’évaluation « uniquement basée sur les lésions » ou sur l’utilisation simultanée de PI‐RADS_v2 et de l’évaluation subjective de Likert au Royaume‐Uni. Le comité a reconnu l’absence de comparaisons directes entre l’évaluation subjective de Likert et la notation PI‐RADS_v2, car les comparaisons à ce jour impliquaient l’évaluation de Likert et PI‐RADS_v1 21 , 22. La majorité du panel n’était pas d’accord avec les recommandations actuelles du rapport PI‐RADS_v2 selon lesquelles la taille de la lésion devrait être le seul facteur de différenciation entre un score de 4 et 5 pour la probabilité de tumeur.
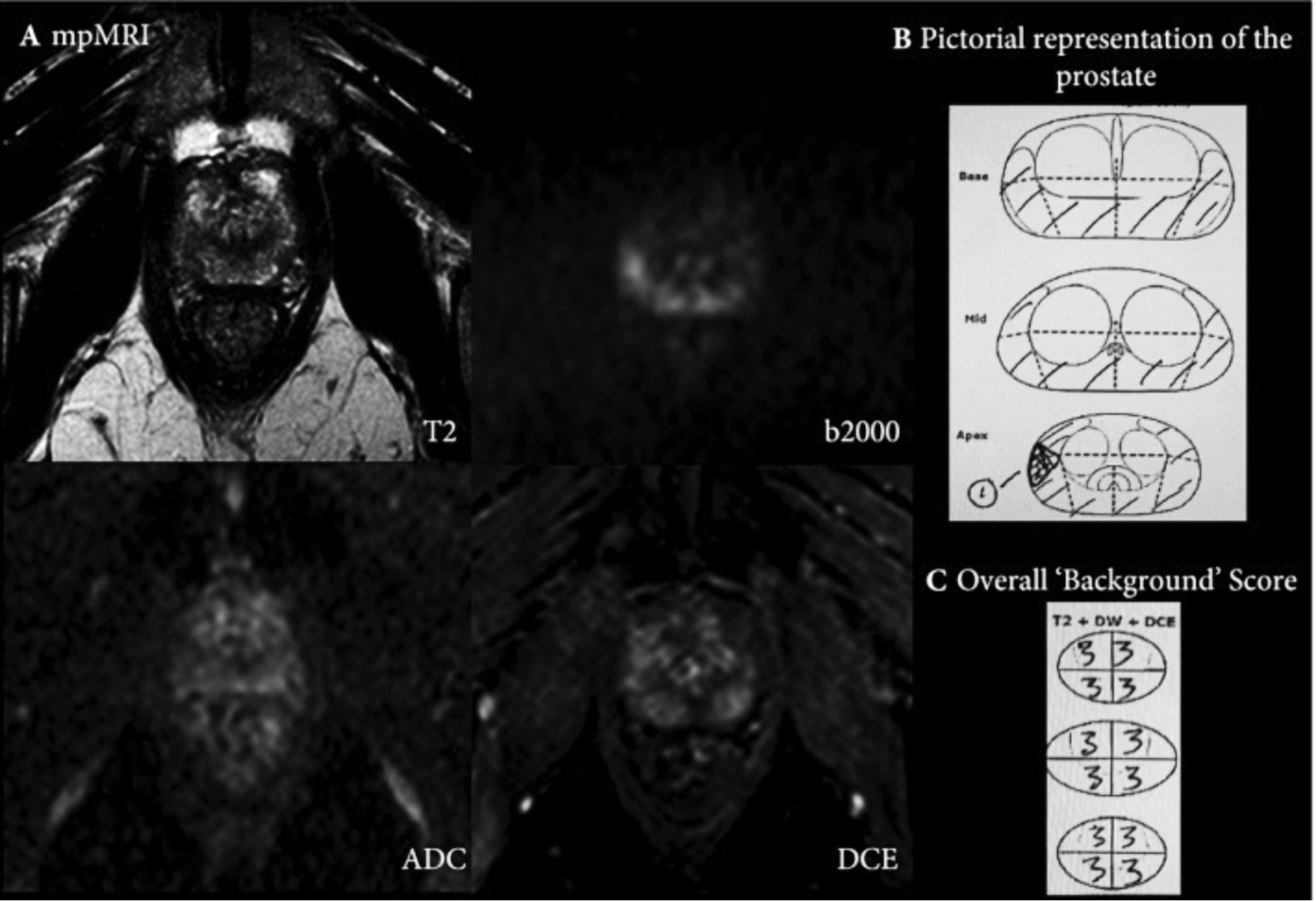
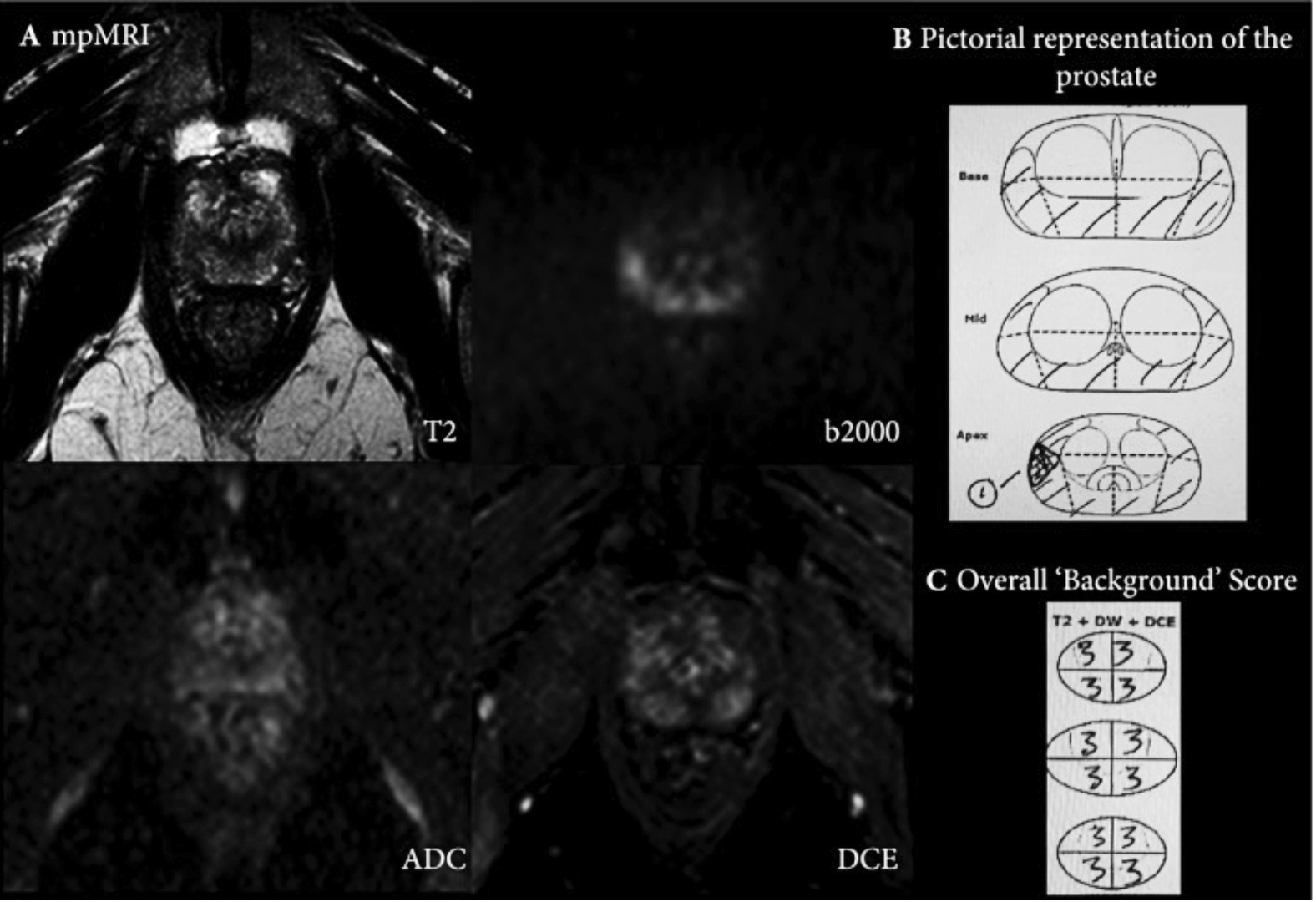
En plus de l’évaluation basée sur les lésions, le reste de la prostate doit également être noté sur une échelle d’évaluation subjective de Likert en 5 points, afin d’évaluer l’importance du changement de signal de « fond » diffus dans la glande, qui peut potentiellement masquer une tumeur importante et biopsie rapide (comme illustré à la Fig.Fig. 1).1). Il convient de noter que l’évaluation de la glande entière n’est pas abordée dans PI‐RADS_v2. Le volume de la prostate et de la tumeur doit être rapporté (le plan sagittal pour mesurer le diamètre antéro‐postérieur et la hauteur de la glande, et le plan axial pour la largeur de la glande se sont avérés plus précis pour l’estimation du volume de la glande 23 ; il convient de noter que l’utilisation de la formule semi-ellipsoïdale pour l’estimation du volume de la lésion est pratique mais pas encore validée). Il n’est pas nécessaire de rapporter les valeurs du coefficient de diffusion apparent (ADC) des lésions compte tenu de la variabilité entre les scanners et les centres 24 , 25 . Lors du calcul de la densité PSA, le comité a recommandé l’utilisation de volumes basés sur MR plutôt que sur des volumes basés sur TRUS, pour une plus grande précision 26 .
PMC full text:
BJU Int. 2018 Jul; 122(1): 13–25.
Published online 2018 Jun 5. doi: 10.1111/bju.14361
Copyright/LicenseRequest permission to reuse
( A ) Montre l’ IRM mp d’un homme de 62 ans, avec un taux de PSA de 4,4 ng/mL et un volume de glande de 25 mL au niveau de la région médiane à l’apex. Sur l’imagerie T2W, il y a un signal T2 bas diffus et inégal et un signal T2 bas au niveau de la glande latérale droite, avec un signal élevé équivoque focalisé sur la valeur b élevée de diffusion à 9 heures et un signal ADC bas équivoque correspondant avec une amélioration bilatérale sur DCE . La lésion focale (représentée par le numéro 1 sur 1. ( B ) a été rapportée avec une évaluation de Likert de 3/5. En outre, le reste de la glande a également été évalué avec la prostate entière divisée en quartiers pour l’évaluation de Likert ( C). Chaque trimestre a été signalé comme une « évaluation de Likert » 3/5. Les changements de fond notés 3 sont représentés par la zone ombrée en B . Lors d’une biopsie de cartographie transpérinéale, la prostate s’est avérée héberger un adénocarcinome Gleason 3 + 4, (implication de 40 % du noyau de biopsie) à l’apex postérieur droit, une néoplasie intraépithéliale prostatique focale de haut grade à l’apex postérieur gauche et Gleason 3 + 3, à huit sites différents dans la prostate (implication de 10 à 40 % du noyau de la biopsie).
Pour les diagrammes illustrés de la prostate, il y avait une incertitude quant à l’utilisation systématique d’un minimum de 12 secteurs ou d’un diagramme PIRADS_v2 étendu de 36 secteurs. Cependant, le panel a tous souligné les avantages d’une identification claire et d’une description efficace de toutes les lésions visibles à l’IRMmp – celles-ci peuvent être soit : dessinées sur n’importe quel diagramme de modèle de prostate sectorisé (dessiné à la main ou généré par ordinateur ); indiqué/contourné sur la séquence, il est mieux visible dans le système de communication d’archivage d’images ; capture d’écran comme images clés ; enregistrées sous forme d’images annotées ou indiquées dans le texte narratif par des numéros de séquence et de tranche.
Double déclarationBien qu’il ne soit pas nécessaire de relire toutes les IRMmp, il y avait un consensus sur le fait que les IRMmp équivoques de la prostate (impression Likert 3) devraient être lues deux fois, si l’on envisage d’éviter la biopsie. De plus, les scores mpMRI discordants avec les résultats de la biopsie doivent être relus rétrospectivement par un autre radiologue. Tout uro‐radiologue ou radiologue ayant un intérêt spécialisé dans l’imagerie mpMRI de la prostate répondant aux exigences minimales pour un rapport indépendant serait jugé approprié de relire les scans.
Section IV : AQ/CQ de l’IRMp de la prostate
L’établissement de normes de qualité nationales pour effectuer l’IRMp de la prostate a été envisagé dans cette section, parallèlement à l’imagerie mammaire, où des normes de qualité nationales sont établies pour garantir des services d’imagerie sûrs, fiables et précis dans des établissements accrédités.
Cependant, le cancer de la prostate ne faisant pas partie d’un programme national de dépistage, aucun consensus n’a été atteint pour définir des normes d’AQ strictes équivalentes à l’imagerie mammaire. Cela relèverait en fin de compte de la compétence et de l’expertise des organismes d’accréditation à mettre en place à l’avenir. Néanmoins, certains domaines de la table ronde couvrant les aspects d’AQ spécifiques au site, spécifiques au scanner, spécifiques à l’image et spécifiques au radiologue sont mis en évidence ci-dessous.
Bien qu’il n’y ait pas eu de consensus, une majorité de 67 % des répondants étaient favorables à l’accréditation des sites pratiquant l’IRMp de la prostate, qui serait administrée par un organisme national. Un centre accrédité doit être en mesure d’effectuer des T2W, DWI et DCE‐MRI conformément aux dernières directives nationales et d’effectuer ou de référer des patients pour une biopsie, des discussions lors de réunions MDT et un traitement.
De plus, il a été convenu par consensus que chaque scanner devrait subir des procédures régulières d’AQ/CQ afin d’effectuer une IRMp de la prostate. Il s’agit déjà d’une exigence d’AQ de routine pour les scanners au sein des institutions du NHS. Des conseils détaillés sont disponibles sur le site Web de l’American College of Radiology (ACR)/Association of American Physicists in Medicine (AAPM) 27 .
Pour l’évaluation de la qualité de l’image diagnostique, des évaluations qualitatives et quantitatives ont été discutées. Alors que l’utilité de l’évaluation quantitative de l’image n’était pas claire, l’évaluation qualitative par l’évaluation visuelle de l’image par un radiologue analysant les images (par exemple, la recherche d’artefacts pour inciter la correction, l’évaluation de la visibilité des lésions, etc.) a été reconnue comme adéquate pour déterminer l’acceptabilité du diagnostic.
Pour que les radiologues maintiennent la performance des rapports au fil du temps, le panel a soutenu l’utilisation de tests d’auto‐performance combinés, d’évaluations de performance externes et d’audits en établissement. Le développement de tout outil d’évaluation des performances en ligne pourrait inclure des cas d’IRM non validés par histologie pour comparer les performances du radiologue à des experts et/ou utiliser des cas validés par histologie pour évaluer la sensibilité, la spécificité, les faux négatifs/positifs et la précision du radiologue pour un cancer significatif.
Il a été reconnu que ces caractéristiques de performance refléteraient non seulement l’expertise de l’opérateur de biopsie, mais également celle du radiologue déclarant. Ces évaluations aideraient à identifier les radiologues sous-performants pour motiver l’amélioration de soi, comme l’augmentation du nombre de rapports d’IRMmp soutenus par des commentaires continus d’experts ou de pairs examinateurs, une deuxième lecture par un radiologue expérimenté pendant une période définie, l’augmentation de l’IRMmp à la pathologie corrélations, par exemple au cours des 6 à 12 prochains mois, avant toute réévaluation.
Section V : Prise en charge des patients après les résultats de l’IRMp de la prostate
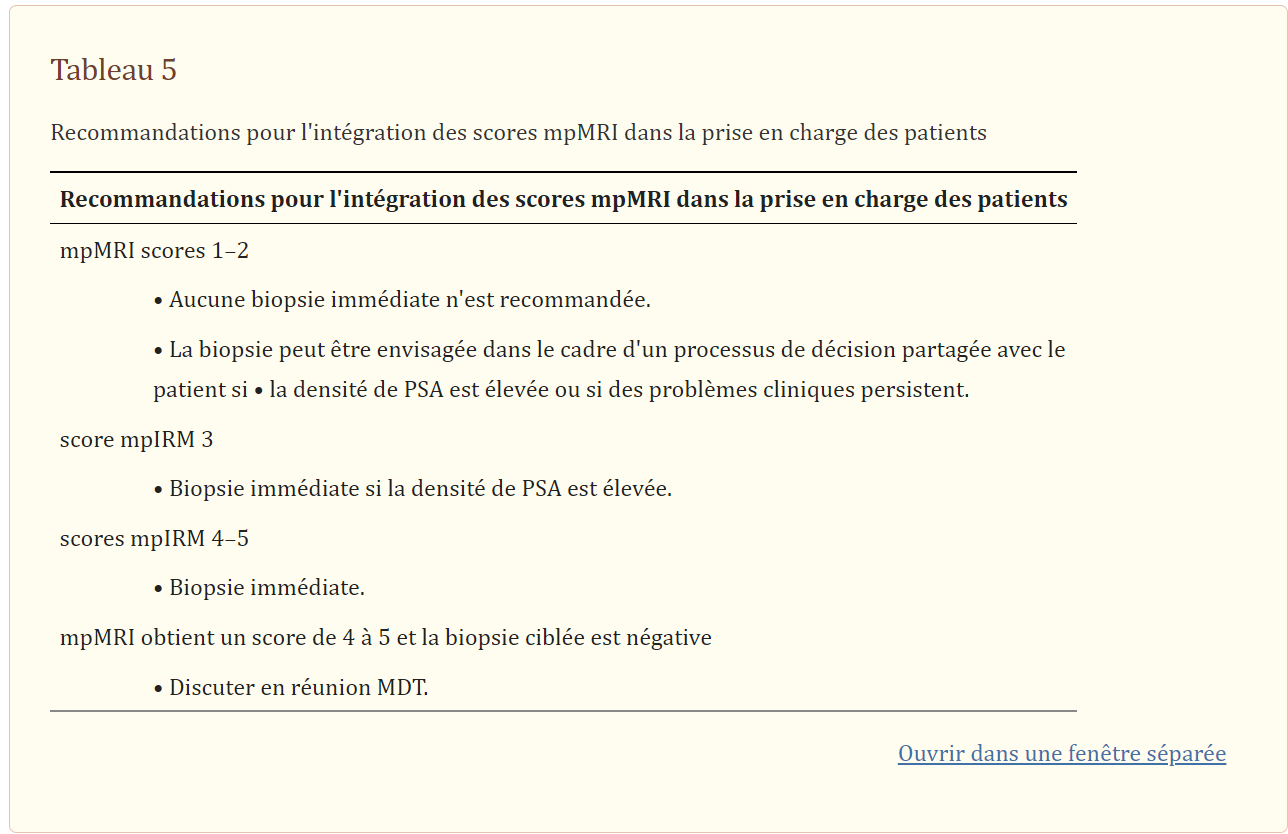
Bien que tous les facteurs cliniques ne soient pas formellement considérés comme des éléments pour le vote par consensus, il était clair que le score IRMmp pré‐biopsie ne devrait pas être le seul facteur guidant les décisions quant à l’opportunité d’une biopsie. D’autres facteurs tels que l’âge, les antécédents familiaux, l’utilisation d’inhibiteurs de la 5α‐réductase, les comorbidités, le PSA total, la cinétique du PSA, la densité du PSA, les tests de bandelette urinaire (pour exclure l’infection), les résultats de biopsie antérieurs et la préférence du patient, peuvent être pris en compte conjointement.
Lorsque l’IRMmp pré‐biopsie est notée 1–2 (non suspecte d’un cancer cliniquement significatif) et que la densité de PSA est inférieure à un seuil convenu, il a été convenu par consensus que le patient peut être renvoyé chez le médecin généraliste avec un suivi de PSA, c’est‐à‐dire sans une biopsie immédiate est nécessaire. Cependant, lorsque la densité de PSA est supérieure au seuil convenu, la biopsie doit être discutée avec le patient dans le cadre d’un processus de prise de décision partagé discutant des risques de maladie présents (~ 0 à 24 % des IRMmp négatifs hébergent un cancer important selon la définition utilisé 2 , 8 , 28 , 29 , 30 , 31 , 32 , 33 , 34et les risques liés à la procédure de biopsie. La technique de biopsie recommandée pour les hommes qui, pour des raisons cliniques, sont conseillés ou choisissent de subir une biopsie malgré une IRM-mp non suspecte est toute biopsie systématique transpérinéale (10/12, 83 % des panélistes) en raison de l’absence de cible IRM visible ; une biopsie TRUS systématique n’augmenterait le taux de détection que de 1 à 2 % 31 , 32 et n’a pas été jugée utile en présence d’une IRMmp non suspecte.
Pour les empreintes IRMmp équivoques (évaluation Likert‐3), une biopsie est recommandée lorsque la densité de PSA est supérieure à un seuil convenu (consensus unanime). Il y avait un accord, mais pas de consensus, sur le fait que les jeunes patients (sept des 12 panélistes) et ayant des antécédents familiaux positifs (huit des 12 panélistes) pouvaient également subir une biopsie si l’IRMmp était notée 3. Il a été convenu, mais pas de consensus, que les options de biopsie dans les situations équivoques L’IRMmp doit inclure une biopsie guidée par IRM (estimation visuelle, fusion d’image ou intra‐alésage ; huit des 12 panélistes), une biopsie systématique transpérinéale (sept des 12 panélistes) ou un échantillonnage combiné ciblé et systématique (sept des 12 panélistes) de la glande. De nouvelles preuves ne montrent aucune différence statistique entre l’utilisation de la biopsie combinée ciblée et systématique par rapport à chaque technique de biopsie seule pour la détection significative du cancer dans les lésions équivoques35 .
Une biopsie immédiate est recommandée en cas d’IRMp pré‐biopsie suspecte (évaluation Likert 4–5) ; Une IRMmp suspecte suivie d’une biopsie ciblée négative doit être discutée dans le cadre d’une réunion de l’équipe multidisciplinaire pour une décision de prise en charge collective, où la possibilité d’une biopsie ciblée manquée ou d’un rapport d’IRMmp faussement positif serait à la fois envisagée. TableTableau55résume la discussion de cette section.
Section VI : Formation sur les rapports d’IRMp de la prostate
Il a été convenu à l’unanimité que le rapport d’IRMp de la prostate ne peut pas être autodidacte. Avant de commencer le reporting indépendant de l’IRMmp, les radiologues doivent entreprendre une combinaison de cours théoriques de base sur l’IRMmp de la prostate, une pratique sur des postes de travail avec un reporting supervisé, et doivent également participer à des réunions MDT ou assister à des ateliers de type MDT où des scénarios cliniques basés sur le patient sont discutés. La formation devrait être dispensée et certifiée par des organismes nationaux tels que le Royal College of Radiologists. Tablemet en évidence les domaines d’accord du panel dans cette section.

Discussion
Le présent article rapporte les recommandations formelles du Royaume-Uni issues d’un processus de consensus RAM pour guider la pratique de l’IRMp de la prostate avant la biopsie dans les centres experts et non experts. Des recommandations ont été faites pour garantir des analyses IRMmp de qualité constante et améliorer les normes de notification afin d’offrir une meilleure orientation dans les décisions de gestion.
Implications cliniques
Il existe un certain nombre de déclarations clés qui, selon nous, auront un impact significatif sur la voie de diagnostic du cancer de la prostate au Royaume-Uni.
Tout d’abord, nous avons défini les conditions minimales pour une IRMp de la prostate. Cela inclut la valeur ajoutée du DCE‐IRM, qui a été récemment remise en question 36 , 37 , 38 , 39 , 40 , 41 . Un récent audit britannique a révélé que 24 % des centres du NHS ne réalisent pas d’IRM de la prostate avec DCE 9 ; il a été constaté que la principale raison de la non‐conformité aux directives du Royaume‐Uni et de la PI‐RADS 11 , 12était due à des problèmes de capacité. Cependant, le panel recommande toujours l’utilisation du DCE comme partie intégrante de l’IRM de la prostate, c’est-à-dire qui évolue du bi‐paramétrique (T2W et DWI) à l’IRMmp, avec l’ajout du DCE‐MRI. Les avantages du DCE‐MRI incluent le fait qu’il agit comme une solution de secours pour surmonter les défaillances techniques de DWI et les artefacts (tels que l’artefact de susceptibilité dû aux gaz rectaux et la distorsion due au remplacement de la hanche), qui entravent la précision du diagnostic 19 , 42 , 43 , 44 , 45 . En outre, le DCE‐MRI est utile pour les radiologues moins expérimentés 46 et également bénéfique pour différencier le stroma fibromusculaire antérieur des tumeurs antérieures 47. L’IRM‐DCE peut également agir comme une séquence de « sécurité » chez les patients où les images de diffusion sont considérablement déformées par un artefact de susceptibilité provenant de l’air dans le rectum ou des arthroplasties totales de la hanche. De plus, le DCE améliore également la confiance concernant les lésions identifiées, en particulier pour celles de nature indéterminée 19 , 48 , 49 .
Deuxièmement, nous avons également remis en question l’utilisation généralisée du système de notation PI‐RADS_v2 et avons recommandé l’utilisation d’une évaluation subjective de Likert en 5 points des IRMmp au Royaume‐Uni en attendant une validation de niveau supérieur et une évolution ultérieure du système de notation PI‐RADS (notant que PI‐RADS_v3 est actuellement en cours de développement). Bien que PI‐RADS_v2 promeuve une approche de notation objective basée sur les lésions 12 , il n’inclut pas l’évaluation de routine de l’ensemble de la prostate, par exemple, l’importance du changement de signal « de fond » diffus dans l’ensemble de la glande n’est souvent pas abordée 50. Même si la dominance d’une séquence dans l’évaluation des lésions PZ/TZ était reconnue, les tumeurs présentant une forte suspicion de cancer sur la séquence non dominante (par exemple, T2 dans la PZ ou ADC dans la TZ) pouvaient être manquées avec PI‐RADS_v2. En outre, ce dernier ne s’intègre pas dans d’autres zones, c’est-à-dire la zone centrale, le stroma antérieur et l’interface zonale où l’origine zonale n’est pas claire. Ce sont des domaines où un score « Likert‐impression » peut être plus utile. Néanmoins, les radiologues peuvent utiliser les caractéristiques de notation descriptives telles qu’élaborées dans PI‐RADS_v2 pour guider leurs opinions et les compléter avec leur propre expérience, ainsi que des caractéristiques en dehors des critères PI‐RADS_v2 pour former une impression subjective globale de Likert. Le panel a également reconnu que les caractéristiques descriptives de l’IRMmp dans les directives PIRADS_v2 sont particulièrement utiles pour les moins expérimentés et pour la recherche.
Troisièmement, afin de maintenir la qualité des rapports d’IRMmp et de garantir des rapports d’IRMp de la prostate précis et sûrs, des normes minimales pour les radiologues déclarants ont été abordées. Bien que l’effet d’une formation dédiée sur la précision de la localisation du cancer de la prostate sur l’IRMmp, l’effet d’un feedback continu sur la confiance dans le rapport et un effet de « courbe d’apprentissage » aient été documentés, l’établissement d’un nombre seuil d’IRMp de la prostate requis pendant la formation, pour atteindre les rapports indépendants et le maintien de l’expertise font défaut 51 , 52 , 53 , 54. Bien que certains puissent ne pas être d’accord avec le concept de mesures quantitatives pour évaluer la qualité ou l’expérience, la majorité du panel a convenu qu’un radiologue indépendant devrait rapporter plus de 100 IRM de la prostate par an avec une participation régulière aux réunions MDT d’au moins deux fois par mois. De plus, avant le rapport indépendant, le rapport supervisé d’au moins 100 études d’IRMp a été jugé approprié. Par ailleurs, les centres réalisant au moins 250 cas par an étaient considérés comme les mieux à même de dispenser une formation. Ces chiffres sont sous réserve que les analyses répondent également à l’exigence de qualité minimale conformément aux dernières directives du protocole. En outre, il a été souligné que les radiologues généralistes ne doivent pas déclarer l’IRMp de la prostate à moins qu’ils n’aient un intérêt spécialisé dans l’IRMp de la prostate,
Ce groupe d’experts a lancé la discussion sur l’assurance qualité spécifique à l’IRMp de la prostate, mais il a été reconnu que davantage de groupes techniques spécialisés dotés d’une expertise spécifique en matière d’assurance qualité sont nécessaires pour mettre en place des exigences d’assurance qualité pertinentes pour l’ensemble du parcours du cancer de la prostate, y compris les procédures d’assurance qualité pour la pathologie, la chirurgie et collecte de données. Les exigences d’assurance de la qualité pour la voie de diagnostic du cancer du sein 55 pourraient servir d’exemple d’approche.
Enfin, nous avons examiné qui devrait être biopsié sur la base des rapports mpMRI. Il y avait un consensus sur le fait que le rapport de l’IRMmp devrait être utilisé pour déterminer si un homme doit être biopsié, en capitalisant sur la sensibilité élevée et les valeurs prédictives négatives élevées de l’IRMmp pour exclure le cancer de la prostate cliniquement significatif et entre un quart et un tiers des hommes seraient donné la possibilité d’éviter une biopsie immédiate. Littérature croissante sur l’utilisation combinée de la densité PSA avec l’IRMmp comme facteur supplémentaire pour réduire les faux négatifs de l’IRMmp 50 , 56 , 57 , 58 , 59 , 60 , 61a été approuvé par le comité pour mieux sélectionner les patients pour la biopsie après une IRMmp non suspecte et équivoque 35 , 57 , 62 . Alors que divers seuils de densité de PSA ont déjà été suggérés 63 , 64 , 65 , le seuil de 0,15 ng/mL/mL s’avère utile dans le cadre du diagnostic 57 , 58 , 59 , 66 , bien que certains centres puissent choisir d’être plus conservateurs en utilisant un seuil de densité de PSA inférieur (par exemple 0,12 ng/mL/mL) parallèlement à d’autres facteurs de risque pour décider quels hommes peuvent éviter une biopsie jusqu’à ce que des preuves plus solides soient disponibles.
Implications pour la recherche
Certains domaines n’ont pas atteint le consensus, en raison de résultats contradictoires ou du manque de données dans la littérature pour guider les discussions. Les domaines de recherche à venir comprennent : les comparaisons de détection/perceptibilité des lésions à partir des valeurs b longues dédiées et extrapolées/calculées à 3 T et 1,5 T sans bobines endorectales ; évaluations quantitatives de la qualité d’image; développement spécifique d’un fantôme MR-prostate ; nombre seuil d’études d’IRMmp requises pendant et après la formation en IRMmp de la prostate et pour atteindre un rapport autonome ; risque clinique à long terme de cancer et résultats de néoplasie intraépithéliale prostatique de haut grade (HGPIN), de petite prolifération acineuse atypique (ASAP), d’atrophie ou d’inflammation lors du diagnostic pour les options de prise en charge dirigées par l’IRM-mp 67 , 68; et en combinant l’IRMmp avec des biomarqueurs moléculaires/génomiques, des calculateurs de risque (autres que ceux validés par TRUS‐biopsie) tout au long de la voie du cancer de la prostate pour le diagnostic.
Limites méthodologiques
Les discussions des groupes d’experts sont sujettes à des préjugés, mais les dernières données disponibles ont été utilisées et un président indépendant a assuré des débats équilibrés. Même si un ou deux panélistes dominaient la discussion, ils n’avaient qu’un seul vote. Par ailleurs, certains membres du panel ont noté les items avant la réunion mais n’étaient pas présents lors de la réunion en face à face. Alors qu’un représentant des médecins généralistes dans notre panel aurait été bénéfique pour répondre aux questions initiales impliquant les médecins généralistes, la contribution au reste du document serait limitée. Enfin, ce processus ne vise pas à atteindre un consensus dans les domaines de désaccord ou à minimiser les incertitudes dans les domaines cliniques, mais il a aidé à identifier les domaines justifiant des recherches supplémentaires.
Aller à:
conclusion
La promesse de l’IRMmp se reflète dans l’adoption rapide de cette enquête dans la pratique clinique et la demande croissante d’offrir ce test à travers le Royaume-Uni. Nos déclarations de consensus démontrent un ensemble de critères nécessaires à la diffusion fiable de l’IRMp de la prostate comme test de diagnostic avant la biopsie chez les hommes à risque. Il est de la plus haute importance que la qualité soit maintenue tout au long de la voie de la prostate dans tous les établissements de soins de santé pour que l’IRMp de la prostate soit utilisée comme un outil pour exclure et exclure un cancer de la prostate cliniquement significatif.
Membres participants et contributions des auteurs
Président de la réunion : Jan van der Meulen.
Panélistes qui ont accepté de faire partie du processus : huit radiologues (Clare Allen, Tristan Barrett, Alexander PS Kirkham, Phil Haslam, Anwar R. Padhani, Amit Patel, Jonathan Richenberg, Shonit Punwani), sept urologues (Jim Adshead, Hashim U. Ahmed, John Graham, Christof Kastner, Alan McNeill, Caroline M. Moore, Ghulam Nabi), deux oncologues (Chris Parker, John Staffurth), trois radiographes (Darren Walls, Jacqueline Pursey, Alexandra Lipton) et un physicien (Alan Bainbridge).
Panélistes ayant rempli le questionnaire : Clare Allen, Tristan Barrett, Alexander PS Kirkham, Phil Haslam, Amit Patel, Jonathan Richenberg, Shonit Punwani, Hashim U. Ahmed, Jim Adshead, Christof Kastner, Caroline M. Moore, Ghulam Nabi, Chris Parker, John Staffurth, Darren Walls, Jacqueline Pursey, Alexandra Lipton, Alan Bainbridge.
Panélistes ayant participé à la réunion en personne : Clare Allen, Tristan Barrett, Alexander PS Kirkham, Phil Haslam, Amit Patel, Jonathan Richenberg, Shonit Punwani, Hashim U. Ahmed, Christof Kastner, Caroline M. Moore, Chris Parker, John Staffurth, Darren Walls, Jacqueline Pursey, Alan Bainbridge.
Coordonnateur de la réunion : Mrishta Brizmohun Appayya.
Révision critique du questionnaire et du manuscrit pour un contenu intellectuel important : Jim Adshead, Hashim U. Ahmed, John Graham, Christof Kastner, Alan McNeill, Caroline M. Moore, Ghulam Nabi, Chris Parker, John Staffurth ; Darren Walls, Jacqueline Pursey, Alexandra Lipton, Alan Bainbridge; Clare Allen, Tristan Barrett, Francesco Giganti, Edward W. Johnston, Alexander PS Kirkham, Phil Haslam, Anwar R. Padhani, Amit Patel, Jonathan Richenberg, Jan van der Meulen, Shonit Punwani.
Élaboration du questionnaire : Mrishta Brizmohun Appayya, Hashim U. Ahmed, Clare Allen, Alan Bainbridge, Alexander PS Kirkham, Caroline M. Moore, Shonit Punwani.
Conception et conception de l’étude : Mrishta Brizmohun Appayya, Shonit Punwani.
Analyse et interprétation des données : Mrishta Brizmohun Appayya.
Analyse statistique : Mrishta Brizmohun Appayya.
Obtention de financement : Shonit Punwani.
Soutien administratif, technique ou matériel : Edward W. Johnston, Francesco Giganti, Larissa Moniz, Chris Whittle, Karen Stalbow.
Supervision : Shonit Punwani.